从一个原子取走一个结合得最松的电子所需要的能量叫做它的电离勢,或精确些叫做它的第一电离势。这变化可用下式来表示:
X+能量→X++e-
一般而言对电子层数相同的原子来说,核电荷越大,电离势越高(表7-6)。这是对的,因为核电荷越大,核对电子的弓引力也越大。
因此,一般来说沿着周期前进,后面的元素有较大的电离势。
图7-1指出一些元素的第一电离势和原子序数的关系。第一电离势的数值提供在表7-7中。请注意硼的电离势小于铍的,这可以通过一个原子带正电的核对不同亚层中电子的相对吸引力来说明。平均来说,核对同一主层中的一个8电子的吸引
要较强于对一个2电子的吸引,而对2电子的吸引又强于对d电子的吸引等等。这表明从一个原子上取走s电子要比取走?电子难些,而取走电子又比取走d电子难些,取走d电子也比取走电子难些,因此电离势按照这个顺序递减。铍(182,282)电离时是失去一个8电子,而硼(182,282,21)电离是失去一个2电子,其结果是硼有较低的电离势,尽管硼原子的核电荷比铍多一个。氮的电离势特别高,而氧的电离势比氮稍低,这是因为氮原子有2p半充满的稳定结构(第3,17节)。类似的变化也出现在以下的各周期中。
在图7-1、表7-6和表7-7中提供的数值是从原子取走结合得最松的电子所需要的能量,并叫第一电离势。取走第二个电子所需要的能量叫做第二电离势,第三、第四等电离势也可用类似的 方式来定义。
金属元素有小的电离势而非金属元素有较大的电离势。这表明金属容易失去价电子而形成正离子,而非金属在化学反应中没有形成正离子的倾向。
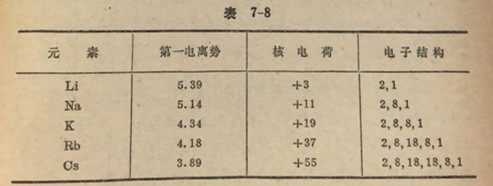
带正电荷的原子核对价电子的引力,由于在内层中电子彼此之间以及它们对价电子间的排斥力而部分地被抵消。于是从原子取走一个电子时,它将受到内电子层对核的屏蔽作用。这种屏蔽作用以及外层电子与核距离的增大,这是在每族中从上向下元素依次有较小的电离勢这个事实的明显的解释。同一族元素照例是有相同的外电子层结构和相同数目目的价电子(表7-8)。
电离势的大小在某种程度上是金属化学活泼性的衡量尺度。也是它失去价电子形成正离子的倾向的衡量尺度。一般而言,电离势越小,金属的活泼性越强。除了可能例外的金属钫外,铯有最小的电离势并且是最活泼的金属。