






元素硼的电子结构是1s22s2p1。因此,在这一周期从硼开始,p轨道对于成键起着重要的作用。我们曾注意到,原子轨道组合起来既能产生分子轨道又能产生π分子轨道,和生成的两个πp,成键轨道具有相等的能量。当有两个或更多个分子轨道处在相同的能级时,在这些轨道中发生任何电子配对之前,电子首先倾向于成单地充填到各个分子轨道中。可以回忆一下这种情形同原子轨道中的情形完全一样(参见第3.17节)。
我们早已指出,op的能级略低于两个πp轨道的能级,但有时也有相反的情况。B2分子(已知这个分子是存在的)的磁性实验数据告诉我们这个分子含有两个不成对电子。这表明,在这个特殊情况中,两个πp轨道的能量低于op轨道的能量,因而电子优先成单地充填进πp轨道中,、每一个πp轨道中充入一个电子。如果op轨道的能量低于两个πp轨道的能量,那么可以估计到两个电子将成对地进入一个轨道之中。图5-9是B2的分子轨道能级图,图中绘示出有两个成单电子。
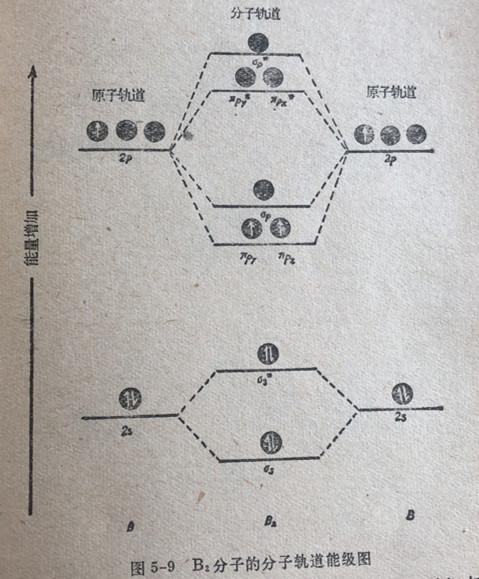
在os和o*s轨道中的四个电子,在能量上彼此互相抵消,因而对于B2分子的稳定性不起重要作用。不过,两个πp电子占入成键分子轨道中,这个事实表明,由两个硼原子组合成二硼分子应该是可能的。已知这个分子是存在的证明了这个事实。
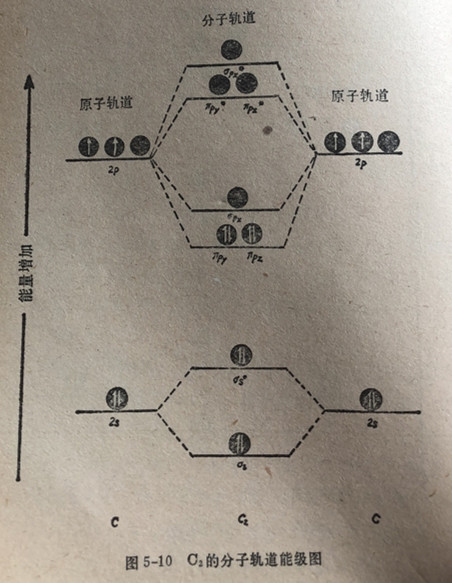
对于生成C2分子来讲,情况同B2的情形一样,不同的必须考虑在每个原子中又各增加了1个电子。与硼的情况一样,对于碳原子来说,认为πp轨道的能级低于σp轨道的能级(图5-10)。分子轨道能级图表明C2分子应该是能够存在的,而事实也确实如此。