氧化数有时叫氧化态,它用于标志原子的正性或负性。在化学反应中当一个原子的价电子被移走了或偏离了,我们就给这原子规定一个正氧化数,并说它处于一种正氧化态。在化学反应中当一个原子获得了电子,或有电子偏近它,我们便给这个原子一个负氧化数,或说它处于一种负氧化态。氧化数的数值决定于每个原子所转移或偏离或偏近的电子数。
对离子型物质来说,元素的氧化数等于离子的电荷。在氯化钠中,钠的氧化数是+1,氯的氧化数是一1;在氧化镁MgO中,镁的氧化数是+2,氧的氧化数是一2;在溴化钙CaBr2中,钙的氧化数是+2,溴的氧化数是一1。为了方便起见可以把一种原子的氧化数的数字和正负号标明在化学符号的上方。
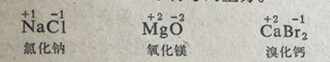
对于共价型的物质来说,氧化数概念是比较武断的,但尽管如此它对书写化学式仍是有用的,在后面第16章我们将可看到,它对于配平氧化还原反应方程式也是很有用的。在含有两种元素的共价化合物中,给电负性较大的元素指定一个负氧化数。给电正性较大的元素指定一个正氧化数。在共价分子HC1中,氢原子的氧化数为+1,因为氢原子的价电子偏移(但不是转移)向电负性较大的氯原子一边。在HCl中氯原子的氧化数为ー1。碳的电负性大于氢,因此在甲烷CH4中,习惯上说碳的氧化数是一4,氢的氧化数是+1;共用电子偏近于碳原子子。在二氧化碳CO2中,氧的电负性大于碳,因此,在这个化合物中氧的氧化数是一2,碳的氧化数是+4,在水H20中,每个氢原子的氧化数是+1,而氧的氧化数为一2。

单质的氧化数总指定为零。单质给以氧化数零是因为相同元素的原子具有相同的电负性。在相同元素的原子间形成化学键时并没有电子的转移或净偏移。
许多元素在它们的不同化合物中有不止一种氧化数。举来说,在FeCl2中铁的氧化数是+2,而在FeCl3中它的氧化数是+3锡在SnCl2和SnCl4中的氧化数分别是+2和+4。在每个上达化合物中氯的氧化数是一1。不过氯的氧化数在 Nacio中是+1
在NaC1O2中是+3,在NaC1O3中是+5,在NaC1O4中是+7。
如果在一个化合物中只有一种原子的氧化数是未知的,这个未知的氧化数可以通过计算求出。在一个化合物中原子和离子的正氧化数与负氧化数的代数和必须永等于零。例如在Na2SO4中,硫的氧化数可以从钠和氧的已知氧化数来计算。每个钠原子的氧化数为+1,2个钠原子的总共氧化数为+2;每个氧原子的氧化数为-2,4个氧原子的总共氧化数为-8。由于氧化数之和等于零,硫的氧化数必定是+6。对于Na2SO3来说,同样的计算表明,在这个化合物中硫的氧化数是+4。在H2S中,硫的氧化数是一2。
一些较常见的氧化数提供在第4-3表中。
应该强调一点,虽然氧化数概念给书写化学式和配平氧化还原方程式带来了极大的便利,但这个概念是颇为武断的。特别明显的是在有些化合物里计算出来的氧化数是个分数。举例来说,在Fe3O4中有4个氧原子,每个氧原子的氧化数是一2,总的氧化数为-8。为了使分子为电中性,三个铁原子的总电荷数应该是+8,或每个铁原子的氧化数是+8/3。或+2又2/3。
+2又2/3-2
Fe3O4
氧化数总是对于ー种元素的一个原子而言的,因此在这个例子中铁原子的氧化数是+2。可以注意在这特定的例子中,如果认为有一个铁原子的氧化数是+2(如在FeO中)和有二个铁原子

的氧化数是+3(如在Fe2O3中),那么铁原子的平均氧化数就是+2又2/3。这样一来就可以把Fe3O4分子看成是由一个FeO分子和二个Fe20分子互相结合成的复合体。不过对于所有的这种含有-一种原子有分数氧化数的分子,不能把这种类似的理解方式普遍应用。
在分子中的电子分布比起氧化态来说是分子的比较基本的性质,但在许多情况中在电子分布和氧化态之间存在着一种密切的联系。我们应该时时想到氧化态的计算是一种有用的但是武断的概念。