










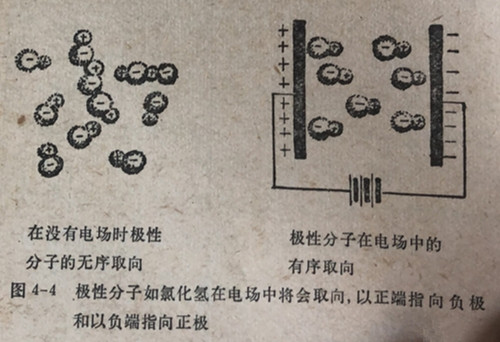
在一个成键原子的体系中,如果它的正电荷中心和负电荷中心不重合,我们说它是极性的。离子型化合物如氯化纳(Na+C1-)可以代表极性物质的一种极端情况,在其中钠离子是完全正性的,而氯离子是完全负性的。当具有不同电负性的原子间形成共价键时,电子对将与电负性较高的原子结合得更紧密些,形成的共价键将会有一些极性。我们已经提到过(第4.4节),在氯化氢分子中,氮原子对电子对的吸引要强于氢原子对电子对的吸引。于是氢-氯键是极性的,形成这个化学键时,氯原子多少有些负性,而氢原子多少有些正性。由于正电荷中心和负电荷中心不重合,氯化氢分子在电性上是不对称的。由于电荷中心的分离,把一个用极性键结合起来的分子放在电场中,它将要转动,分子的正电一端将要指向负极,而负电的一端将指向正极(图4-4)
形成化学键的两个原子的电负性差值越大,键的极性越大。因此,在卤化氢分子中键的极性依如下顺序而增大HI<HBr
HC1<HIF,这和卤素电负性的增高为相对应:I(2.5),Br(2.8),C1(3.0),和F(4.0)。如如果2个原子的电负性差值足够大,电负性较纸原子的电子将会完全转移给电负性较高的原子,这将会形成离子鍵而不是共价键。当两个相同的原子共用一对电子如HH的情况,将会达成另一个极端情况,在其中的键是没有极性的共价鍵。于是这就显得很清楚,在共价键化合物和离子键化合物之间并没有明显的分界线。在中间状况的分子中的键将既具有一些共价键的性质,又有一些离子键的性质,常称之为具有部分离子性的共价,或极性共价键。
可能有这种情况,分子中的价键是极性共价型的,但分子作为一个整体却是非极性的。如果一个分子含有多个极性共价键,但是各键所取的方向使分子成为一个对称分子,那么这个分子是非极性的。可以用HgC12来说明这个问题,在这个分子中每个共价鍵都是极性的,而整个分子却是非极性的。这个分子的正电中心和负电中心是相同的。每个氯原子相对于带正电的汞原子是带负电的,每个汞一氯键都有一些极性。不过由于两个键所指的方向形成了一个电性对称的分子而使键的极性互相抵销了。
C1-_+Hgt_-C1
在常温下共价型化合物可存在为固体、液体或气体。一般来说,它们具有低的熔点和有挥发性。它们在溶液中只要同溶剂发生作用而生成离子时,它们的溶液便能传导电流.
