





为了方便起见可以把周期表中的元素按照它们的原子结构分为四类:
1.惰性气体 这些元素的外电子层完成了8电子(氨是2电子)外売。这些惰性气体的氨(He)、氖氖(Ne)、(Ar)、氪(Kr)、氙(Xe)、氡(Rn)
2.代表性元素 这些元素增加的电子进入最外层,但在这些元素中最外层是未完成的。这些代表性元素是周期表中的IA、ⅡA、표A、IVA、VA、WA和VⅢA旅的元素。
3.过渡元素 这些元素的外数第二层从8电子完成到18电子。这四个过渡系是:
第一过渡系:钪(Sc)到铜(Cu)
第二过渡系:钇(Y)到银(Ag)。
第三过渡系:钢(La);铪(Hf)到金(Au)。
第四过渡系(未完成的):钢(Ac)和106一。
4.内过渡系 这些元素在外数第三层中从18电子完成到32电子。这两个内过渡系是:
第一内过渡系:铈(Ce)到镥(Lu)。
第二内过渡系:钍(Th)到铐(Lr)
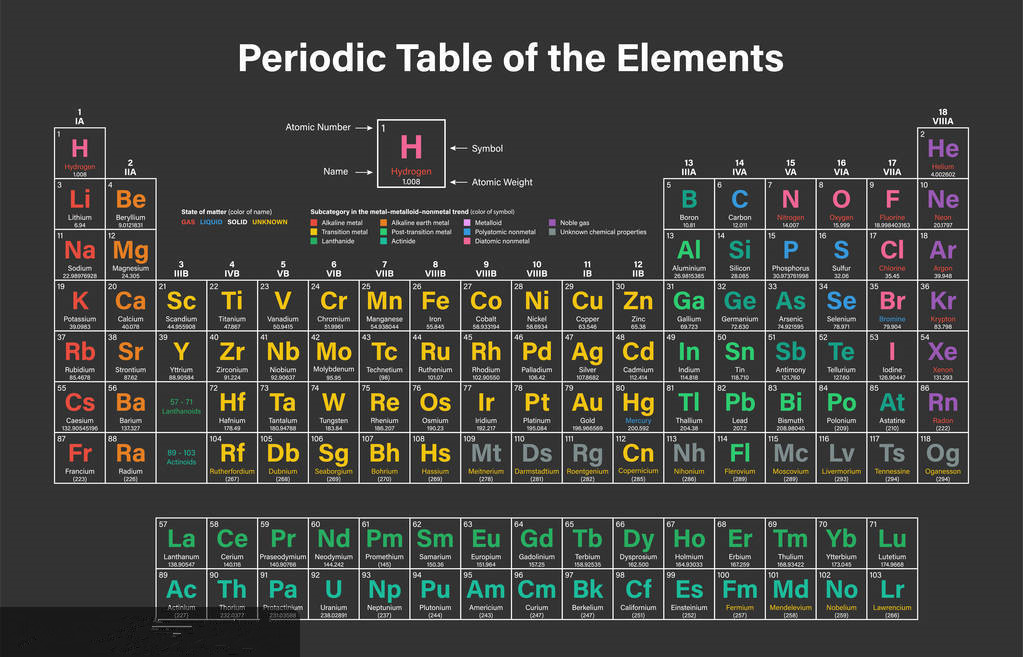
镧和锕由于它们分别与这两个内过渡系的其它元素相类似因而原。有时也包括在内分别作为第一和第二内过渡系的第一个元素)。
有如我们早已指出的,元素的性质主要决定于它们的原子结构。在化学性质上的差异是由三个主要特征造成的:(1)核电荷的大小和核外电子数,这两个都等于原子序数;(2)电子层数和在各层中的电子数,特别是价电子层中的电子数;以及(3)在各电子层中电子彼此之间的距离和它们离核的距离。