物质从溶液里结晶析出的两种方法 任何固体物质都不能元限制地溶解在水里.固体物质在水里能够溶解的量,除了和这种物质的溶解性有关外,还和所用溶剂(水)的量的多少有关,溶剂的量越多,能够溶解溶质的量也就越多,当所用溶剂的量一定时,它所能溶解溶质的量还和外界条件(主要是温度)有关,大多数固体物质的溶解度,都是随着温度的升高时,而增加的。
如果在一定量的溶剂里,加入固体溶质的量,超过了它所剂能溶解的最高限度(或者说超过了它在这一温度时的溶解度)时,那超过的部分,就不会溶解.例如,在20°C时,硝酸钾的溶解度是31.6克,如果在这一温度下,在100克水里加入了在45.8克的硝酸钾,那末,这些硝酸钾,将不会全部溶解在水里,而有45.8克一31.6克=14.2克硝酸钾晶体多余出来怎样才能使这些硝硝酸钾晶体全部溶解呢?
一个方法是在保持温度不变的情况下,加入更多的溶剂(水).根据计算,在20°C时要溶解硝酸钾45.8克,至少须用水145克,因此,只要在溶液里加进45克或46克以上的水硝酸钾的晶体就能全部溶解.
另一个方法是把溶液加热,使溶液温度升高到30°C(硝酸钾在30C时的溶解度是45.8克)或30°C以上,这时,硝酸钾的晶体也能全部溶解。

如果把前面加入了45克水的硝酸钾溶液蒸发,使溶剂水的量减少到原先的100克时,将有什么现象发生呢?很显然,那后来溶解的14.2克硝酸钾晶体,亦将从溶液里重新结晶出来。
由此可以看出:让溶剂蒸发或者冷却溶液,都有可能使固体溶质从溶液里结晶析出.
现在,我们再比较深入地来讨论一下固体自溶液里结晶析出的过程。
当溶液(一般是不饱和溶液)在敞口容器里蒸发时,开始时,随着溶剂(水)的逐渐蒸发,溶液逐渐变浓,但并不立刻就有结晶析出.只有当溶液变成饱和溶液后,如果再继续让溶剂蒸发,溶质才会自溶液中结晶析出。
例如,在20°C时,100克水里溶有32.4克食盐的溶液,是个不饱和溶液(在20C时,食盐的溶解度是36克),把它放在敞口容器里,让它自行蒸发,开始时是不会有食盐结晶出来的,只是溶液逐渐变浓.根据计算可知,当有10克溶剂(水)蒸发掉后,溶液就变成饱和.如果此时继续让它蒸发,就有食盐从溶液里结晶析出.食盐结晶析出的数量,是随着蒸发的不断进行、溶剂(水)的不断减少而逐渐增加的.它结晶析出的结果,是要使得溶液里溶有的食盐不超过它的溶解度.因此,结晶析出的食盐的重量,可以从蒸发掉的溶剂(水)的重量求得.例如蒸发掉20克水,即溶剂重量减少为100-20=80克时,至多能够溶解(温度仍保持20°C)食盐多少克?能结晶析出多少克食盐?这可以由下法求得:
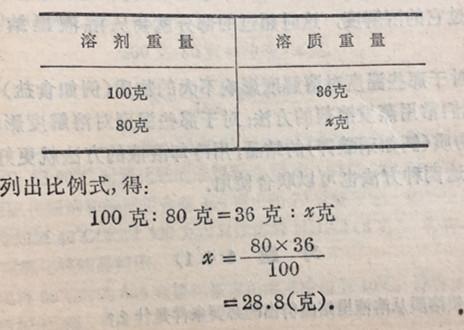
即至多能够溶解食盐28.8克,而有32.4克-28.8克=3.8克的食盐从溶液里结晶析出。
大多数固体物质的溶解度,都是随着温度的升高而增加的.有些物质的溶解度受温度的影响还很大,它们的溶解度曲线很陡。如果把它们的热的饱和溶液缓缓冷却下来,尽管这时溶剂(水)并没有蒸发,溶液也没有变得更浓些,但溶解度由于温度的下降而减小了,从而使得溶液里溶质的量,超过它的溶解度.因此也会有溶质从溶液里结晶析出.例例如,在80℃时100克热水所成的硝酸钾饱和溶液里,溶有KNO3169克把这样的饱和溶液冷却到20°0,因为20C时KNO3的溶解度是31.6克,因此就会有
169克一31.6克=137.4克
的硝酸钾晶体从溶液里结晶析出.
现在我们可以看出,蒸发溶剂和冷却饱和(或接近饱和的)溶液,是使溶质从溶液里结晶析出的两种常用的方法.这两种方法的原理,都是使得溶解在溶液里的溶质的量,从小于它的溶解度(不饱和溶液)到等于它的溶解度(饱和溶液),最后超过它的溶解度,这时超过的部分就会从溶液里结晶析出。
对于那些温度对溶解度影响不大的物质(例如食盐)的结晶,我们常用蒸发溶剂的方法;对于那些温度对溶懈度影响很大的物质(例如硝酸钾)的结晶,用冷却溶液的方法就更好些当然,这两种方法也可以联合使用。