








1.物理性质纯硝酸是一种易挥发、有刺激性气味的液体,能以任何比率溶解于水.它在86C时沸腾,沸腾时有部分硝酸分解.常用的浓硝酸的浓度大约是65%.浓度为98%的硝酸在空气里有“发烟”的现象,所以叫做发烟硝酸.这是因为硝酸里放出的硝酸蒸气与空气中水蒸气相遇,生成了极微小的硝酸液滴的缘故。
2.化学性质硝酸是一种强酸,在稀水溶液里能完全电离出氢离子,具有酸类的通性.例如能使蓝色石蕊试纸变红:能跟碱性氧化物、碱类和盐类起反应,如:
2H++CUO=CU+++H2O
H++OH-=H2O
2H++CO3--=H2CO3
→H2O+CO2↑
此外,硝酸还具有如下一些性质:
(1)不稳定性:纯硝酸或浓硝酸很不稳定,在常温下见光就会分解成氮的氧化物、水和氧气,如受热分解得更快:
4HNO3=(见光或受热)=2H2O+4NO2↑+O2↑
分解生成的棕色的二氧化氮气体溶解在溶液里,使溶液常呈黄色.因此为了防止硝酸的分解,必须把硝酸盛在棕色瓶里,并且放在黑暗而温度较低的地方。
.jpg) (2)氧化反应:硝酸是一种强氧化剂,它能氧化许多非金属,有时氧化很剧烈甚至引起燃烧.例如把一小块燃烧得红热的炭
(2)氧化反应:硝酸是一种强氧化剂,它能氧化许多非金属,有时氧化很剧烈甚至引起燃烧.例如把一小块燃烧得红热的炭
放入热的发烟硝酸里(图57),炭就会被硝酸氧化,使燃烧更加剧烈,并发出明亮的光来.它们的反应是:
4HNO3=加热=2H2O+4NO2↑+O2↑
C+02=CO2↑
把二个方程式合并,消去中间产物氧气,就得到总的反应式
C+4HNO3=加热=2H2O+4NO2↑+CO2↑
硝酸也能氧化多种有机物.例如在纸上滴一滴硝酸,纸张立刻会受到氧化而焦化.如果衣服或皮肤上溅着硝酸,也同样会受到破坏或灼伤.所以使用硝酸(特别是浓硝图5·7炭在浓硝酸里燃烧酸)的时候要特别小心.万一硝酸溅在皮肤上或衣服上时,就应该立刻用大量的水冲洗.
(3)眼金属的反应:硝酸也能眼绝大多数的金属(金、销等少数金属除外)起反应,金属被硝酸氧化生成金属氧化物,接着又进一步跟未分解的硝酸起反应生成硝酸盐盐,同时硝酸本身被还原生成氮的氧化物.因此硝酸跟金属反应后的生前物是硝酸盐、水和氮的氧化物(一般是一氧化氮气体或者二氧化氮气体)の.即使最活动的金属跟硝酸反应的时候,也没有氢气放出来,因为游离出来的氢气被硝酸氧化而成水了。
例如,浓硝酸跟铜反应,就把铜氧化成氧化铜而本身还原成二氧化氮:
2HNO3(浓)+Cu=CuO+2NO2↑+H2O
生成的氧化铜,又立刻跟硝酸反应,生成硝酸铜和水:
Cuo+2HNO3=Cu(NO3)2+H20
把上述二个化学方程式合并,消去中间产物CuO,就得到下式:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
在实验室里,我们就是利用这个反应来制制取二氧化氮的。
稀硝酸也能跟铜反应,使铜氧化成氧化铜,接着生成硝酸铜,但硝酸本身被还原成一氧化氮这个反应要在加热的情况下进行.反应的化学方程式如下:
2HNO3(稀)+3Cu=加热=3CuO+H2O+2NO↑
3cu0+6HNO3 =3cu(NO3)2+3H2O
总的化学方程式是
3Cu+8HNO3(稀)=加热=3Cu(NO3)2+4H2O+2NO↑
在实验室里,我们就利用这个反应来制取一氧化氮的。
如果在1体积的硝酸里加入3体积的盐酸,这个混和溶液的氧化能力将更加强烈.因为它们互相反应后的生成物具有比硝酸更强的氧化作用,所以能腐蚀并溶解那些不能被普通酸溶解的金属,如金与销.这种混和液叫做“王水”。
①在个别的情况下,还会生成铵盐,究竟生成什么,是与硝酸的浓度和金属的活动性有关的。
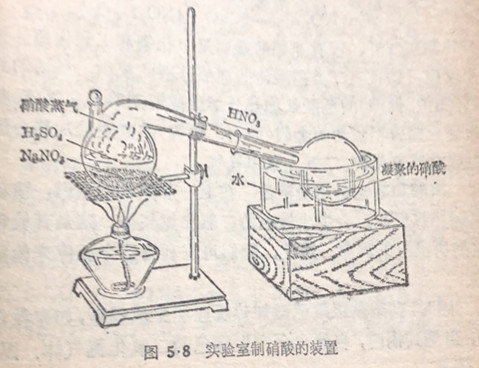
硝酸的实验室制法 硝酸的沸点较低,因此,当硝酸盐和高沸点的酸,如硫酸共熱时,硝酸就会挥发出来,实验室里就一
是利用这个原理来制取硝酸的,一般常用硝酸钠和浓硫酸裝在曲颈甑(音曾)里混和加热:生成的硝酸蒸气冷凝后即制得硝酸(图5.8)。
NaNO3+H2SO4(浓)=加热- NAHSO4+HNO3↑
这个方法和以前讲过的(§1·4)在实验室里制盐酸的方法原理相同,但由于硝酸具有强氧化性,制取时就不能用象制取盐酸时所用的那种配有软木塞或橡皮塞的圆底烧瓶,因为反应时生成的硝酸蒸气会腐蚀软木塞或橡皮塞.所以我们常用一个全部由玻璃制成的仪器叫做曲颈甑,曲颈甑的颈口特别长,可以代替冷凝器,使硝酸蒸气冷却并凝结成液滴,加热的温度不宣大高。否则生成的硝酸将会分解。
硝酸盐 由硝酸根离子(NO3)和金属离子结合丽就的离子化合物,统称硝酸盐.绝大部分硝酸盐都可金属硝酸直接反应而制得.硝酸盐是实验室里常用的试剂,它都易溶于水,并能精制成纯净的晶体.在自然界里存在的、数量较多而有较大经济意义的硝酸盐有硝酸钠(NaNO3)、硝酸钾(KNO3)和硝酸钙[Ca(NO3)2]等几种。
硝酸盐在高温下都不稳定,象浓硝酸一样,加热能多分解解放出氧气气,所以高温下硝酸盐是强氧化剂.但它们的水溶液几乎没有氧化性。
硝酸盐的加熱分解规律不是完全一样的,例如硝酸钾的分解是:
2KNO3=加热=2KNO2+O2↑
产物是氧气和亚硝酸钾(KNO2),它是亚硝酸( IINO2)的一种盐.又如硝酸铜的分解是:
2Cu(NO3)2=加热=2Cu0+4NO2↑+O2↑
产物除氧气外,没有亚硝酸盐而是氧化铜和二氧化氮.这二个反应可以代表二类硝酸盐的加热分解的规律:最活动的金属(如钠,钾等)的硝酸盐加热分解生成亚硝酸盐和氧气;其余大部分比较不活动的金属(如铜,铅等)的硝酸盐加熟分解均生成金属氧化物,二氧化氮和氧气。
硝酸和硝酸盐的检验法 在上一节里我们知道,浓硝酸眼铜加热反应,会生成棕色的二氧化氮气体、这是其他常用酸类所没有的现象,因此,我们可以利用这个反应来检别硝酸。
同时,硝酸盐跟浓硫酸加热反应能生成硝酸,如果数量较多,当遇到铜时,自然也会产生棕色的二氧化氮气体:因此,上述反应可作为间接检验一种盐是否是硝酸盐的根据.如以硝酸钠为例,反应的化学方程式是:
NaNO3+HI2SO4(浓)=加热=NAHSO4+HNO3
3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO↑
2NO+O2(空气)=2NO2(棕色)
所以,检验硝酸盐,可把固体试样放在试管里,加入少许浓硫酸,再加几片铜片,然后加热.如果有棕色气体产生,就可证明这固体试样是一种硝酸盐.
但是,这个检验法对数量多的固体试祥比较正确,对少量或溶液试样,因二氧化氮溶于水,看不到棕色气体放出,有时就不够正确。
硝酸和硝酸盐的用途 硝酸和以前学过的硫酸、盐酸称为化学基本工业的三强酸,有着极为广泛的用途.它是制造多种炸药的必要原料,也可用来制造染料、塑料和多种药剂等.硝酸与氨反应生成的硝酸铵,是含氮量很高的氮肥;所以,它对发展国民经济增强国防力量都有着重要意义.
硝酸盐也有很多用途,除上面曾经提到的用作试剂和制造硝酸外,在工农业上的用途主要有二方面,就是制造炸药和用作肥料.
我国最早发明的黑火药就是用硝酸钾、硫黄、木炭的粉末混和而成的,它的成分大致是75%的KNO3、10%的S和15%的C.黑火药燃烧反应是非常复杂的,大致说来,利用硝酸钾加热后的强氧化性,它剧烈氧化易然的硫和碳,生成气态物质如CO2NY2等和固态物质如KSO,K2CO3,K2S等,反应高速进行同时产生大量热量,使反应的气态产物的体积骤然膨胀,几乎达到原来火药体积的200倍,于是就发生爆炸现象固态物质质的微细颗粒分散在气体中,就形成了浓厚的黑烟,黑火药现在大都用在爆炸矿藏、隧道以及制造烟火等方面。
硝酸铵是一种更不稳定的硝酸盐,所以现在也广泛用它来制造爆炸物,“阿芒拿”就是由硝酸铵和铝粉等各种可燃性物质混和而成的爆炸物物,用于军事和工业的爆炸作业硝酸盐是最易被植物吸收的含氮无机物,所以是很好的氮肥,常用的有NaNO3、KNO3、Ca(NO3)2和NH4NO3等.