电解质和非电解质,试验物质导电性的装置如图4.1所示
取烧杯一只,另取圆形木板一块,木板比烧杯口路大些,中开两孔各插石墨棒一根.石墨棒上各连出一根金属导线,其中一根直接与头相连接,另一根则通过一个灯泡后再与插头相连接接.试验时,先把要试验的物质(固态的、液态的或水溶液液)放入烧杯内,使石墨棒的下端插入其中,然后把插头和电源相连接.如果灯泡发亮,表示试验的物质能够导电;如果灯泡不亮,说明试验的物质不易导电。
各种物质导电性的试验结果,如下面的表4·1所示示:
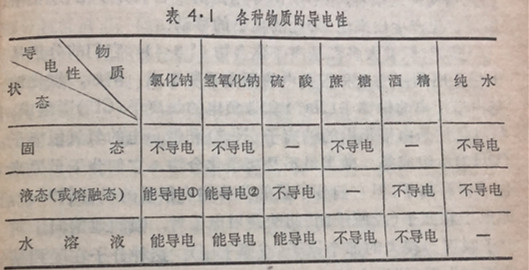
从上表可以看出:干燥的盐类(例如氯化钠)、碱类(例如氢氧化钠)在固态时虽然不能导电,但在熔融状态或溶解于水所成的溶液都能导电;无水的酸(例如纯硫酸)在液态时虽然不能导电,但它们的水溶液能够导电;蔗糖、酒精、纯水则不论是固态、液液态或者是它们的水溶液都不能导电③。
在化学上,把在溶解或熔融状态下能够导电的物质叫做电解质,不能导电的物质叫做非电解质.盐类、碱类、酸类等都是电解质,蔗糖、酒精以及大部分的有机化合物都是非电解质。
①氯化钠的熔点是805C.
②氢氧化钠的熔点是328°C.
③这里所讲的“不能导电”,确切地说应该是“几乎不能导电”.在后面将会学习到,它们并不是绝对不能导电,只是导电能力极其微弱,不能使导电性试验器的灯泡发亮罢了。
电解质的电离 我们怎样来解释电解质在一定条件下所表现出的导电性呢?我们们知道,物质导电是由带电的微粒移动的结果(例如金属导电是由于金属体内电子的移动).根据物质结构理论来看,电解质的导电是由于它们分子里(或在溶解过程里产生出来的)带电的离子的移动。
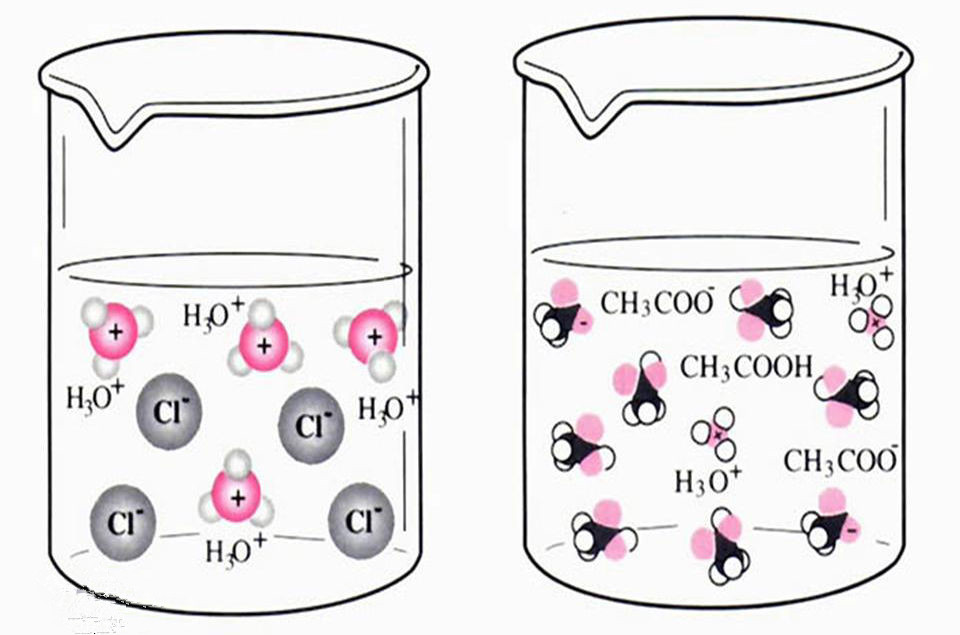
盐类、碱类大多都是离子化合物(§3·4),它们的分子是由带正电的阳离子和带负电的阴离子所组成.,例如,氯化钠是由带正电的钠离子(Na+)和带负电的氯离子(CI-)所组成;氢氧化钠是由带正电的钠离子(Na)和带负电的氢氧根离子(OH)所组成等等.酸类虽不是离子化合物,它们分子里原来也不含有离子,但它们分子里的共价键有很强的极性(3-4)即原子和原子(或原子团)间的共用电子对,强烈地偏向于对电子吸引力较大的那个原子(或原子团).这种分子在受到某种外力作用(例如溶剂分子的作用)时,原来已经偏得很厉害的共用电子对,有可能进一步完全转移给那个对电子具有较强吸引力的原子(或原子团).这时,分子也就分裂成为离子了。
蔗糖、酒精等有机化合物分子里的共价键的极性一是很弱的,即使在溶剂分子的作用下,这些物质的分子仍然不能分裂成为离子,因此这类物质没有导电性。
显然,对于那些具有非极性鍵的非金属单质,例如氯气(C12)、氧气(O2)、氢气(1)等,它们的分子将更难分裂成为离子,因此它们更不可能会有导电性,它们都是非电解质。
但是,离子化合物不论在固态或液态时都含有离子,为什么它们在固态时不能导电,而一定要在液态(熔融状态)或溶解于水时才有导电性呢?
原来在固态的离子化合物里,阳离子和阴离子是一个个相间地、很有规律地排列着的.在阳离子和阴离子间存在着一种强烈的吸引力(即静电引力),使得这些离子不能自由移动,当固态的离子化合物受热熔化时,原来排列列得很整齐的阳离子和阴离子,变得杂乱起来,离子间相互作用的力有部分被抵消了;同时由于温度升高,离子的活动也加强了,它们在熔液①里能够比较自由地移动,另外,当固态的离子化合物溶解于水时,由于水分子的作用,晶体表面上的离子和晶体内部的离子之间的引力大为减弱,在水分子的吸引下,晶体表面上的离子逐渐进入溶液(溶解).在溶液里,每一个离子的周围,都被若干个水分子所包围,称为“水合离子”,这种“水合离子”也能够在溶液里比较自由地运动。
由此可以看出,离子化合物在固态时不能导电,是由于固态离子化合物里的离子不能自由移动的缘故.因此,物质里含有离子,并不能就断定这种物质一定具有导电性;只有当物质里含有的离子(或水合离子)是能够在熔液(或溶液)里自由移动时,才有导电的性质.换句话说,电解质的导电性是电解质里的能够自由移动的离子(简称自由离子)的性质前已述及,具有强极性键的化合物,例如酸类溶解于水时,由于水分子的作用,它们的分子分裂成为带电的离子,这种离子也是以自由离子的形式存在于溶液中的,因此它们的溶液也具有导电性。
电解质溶解于水或受热熔化时产生自由离子的过程,叫做电离.电解质的导电性是电解质电离的结果;非电解质不
能电离,因此非电解质没有导电性。
①这里讲的是熔液,不是溶液.熔液就是熔融状态下的液体.