测定pH值常用的指示电极有玻璃电极和锑电极,而玻璃电极使用最为广泛。
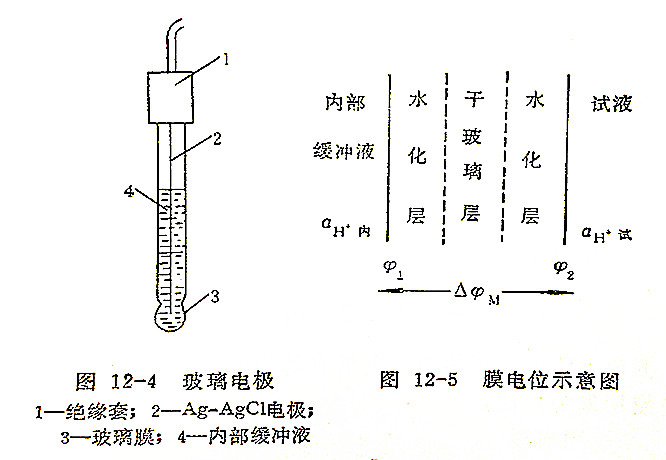
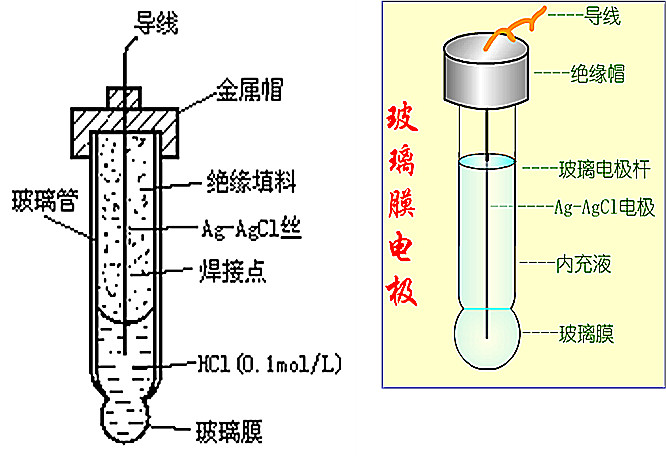
玻璃电极的结构如图12-4所示,它的主要部分是一玻璃泡,泡的下半部是由特殊成分的玻璃制成的薄膜,膜厚约50微米。在玻璃泡中装有pH值一定的缓冲溶液,其中插入一支银-氯化银电极作为内参比电极。
玻璃电极中内参比电极的电位是恒定的,与被测溶液的pH值无关。玻璃电极用于测量溶液的pH是基于产生于玻璃膜两边的电位差△φM,如图12-5所示。
△φM=φ2-φ1=0.0591g(aH+试/aH+内)
由于内部缓冲溶液的H+活度是一定的,所以aH+内为一常数,则:
△φM=K+0.0591gaH+试=K-0.059pH试
K为常数,它是由玻璃电极本身决定的,从上式可以看出玻璃电极的膜电位△φM在一定温度下与试液的pH成直线关系。
实践证明,玻璃膜浸泡在水中才能显示pH电极的作用,未吸湿的玻璃膜不能响应pH的变化。所以一个新买来的玻璃电极在使用前需在蒸馏水中浸泡若干小时,而每次测量完后应置于清水或0.1NHCl溶液中浸泡。
玻璃电极浸泡在溶液中,玻璃膜表面形成很薄的一层水化层,即硅胶层。当水化层与溶液接触时,水化层中H+离子与溶液中的H+离子发生交换而在内外水化层表面建立下列平衡:
H+玻璃 ⇋H+溶液
由于溶液中H+离子浓度不同,会有额外的H+离子由溶液进入水化层或由水化层转入溶液,因此改变了固-液二相界面的电荷的分布,从而产生了电位差。
按理说,当aH+试=aH+内时,△φM应为0,但实际上并不等于0,仍有一个小的电位差存在,这个电位差叫做不对称电位(△φ不对称)。它是由膜内外两个表面的情况(如含钠量和张力等)不完全相同而产生的,△φ不对称的数值约为1~30毫伏,对于不同的玻璃电极,这个数值不完全相同,但对同一支玻璃电极,一定条件下△φ不对称是个常数。
玻璃电极在pH<1的溶液中,测量值偏高,原因尚未清楚。在pH>9的溶液中,测量值偏低,可能是Na+进行交换而造成的,故常称“钠差”。目前已有特种玻璃制成的pH玻璃电极,可以测准到pH=12。
玻璃电极的优点:
① 测定结果准确,在pH1~9范围内使用玻璃电极效果最好。一般配合精密酸度计测定误差为±0.01pH单位。
② 测定pH时不受溶液中氧化剂、还原剂或毛细管活性物质存在的影响。
③ 可用于有色的、浑浊的或胶态溶液的pH测定。
④ 可以连续测定。
玻璃电极的缺点:
① 容易破碎。
② 玻璃性质常起变化,须不时以已知pH值的缓冲溶液核对。
③ 使用一年以后性能就较差。
(1)锑电极的制备 先以锑粉在真空玻璃管中铸成小棒形状,再使其表面盖上一层三氧化二锑的薄膜,连以导线,牢固地装于一个玻璃管的下端即成。
(2)锑电极的作用 锑电极的作用是依靠它表面上的一层Sb2O3对OH-的可逆反应。三氧化二锑溶于水生成Sb(OH)3。
Sb2O3+3H2O ⇋2Sb(OH)3
Sb(OH)3在水中溶解度很小。锑电极工作时,电能是由下面的可逆反应产生的。
Sb(OH)3 ⇋Sb3++3OH-
Sb3++3e ⇋Sb
因此,锑电极的电极电位与溶液中氢氧离子浓度有关,由于水的电离常数是一个定值,所以,锑电极的电极电位也与溶液中氢离子浓度有关。φ=φ°-0.059lgpH
(3)锑电极的优点
① 构造简单,坚固耐用。
② 可用于测定半固体、胶状体、水油混合物的pH值,测定范围约为pH3~12。
(4)锑电极的缺点 准确度不高,约有0.1pH单位误差。在氧化还原性溶液及高浓度钠盐溶液中均有误差。
锑电极适宜于工业上准确度要求不高的pH测定。