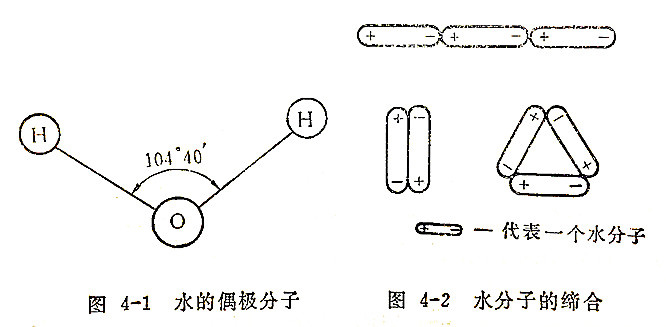
水是无色、无味、无嗅的液体。在760毫米汞柱的大气压下,水的沸点是100℃,水的冰点是0℃,在液态和固态物质中,水的比热最大,水的密度在3.98℃时最大(1克/毫升)。水的这些特性可以用水分子的结构来解释。在水分子中,两个氢原子与氧是不对称的,键角为104°40'(图4-1)由于O—H键具有强极性,因此水分子是强极性分子。又由于水分子中的氢符合生成氢键的条件,即氢与电负性较大的原子氧成键后,氢原子上有多余的作用力,可以吸引另一个水分子中电负性大的原子,生成分子间的键。这种分子间因氢原子而引起的键就叫做氢键。
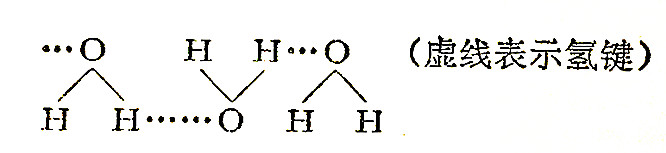

氢键的键能一般在数千卡/摩尔。由于水分子间有氢键,使分子间产生较强的结合力,由简单的分子H2O结合成较复杂的分子(H2O)x,但又不引起水的化学性质改变的现象叫水分子的缔合(图4-2)。
水在液态时是缔合的,在3.98℃时以(H2O)x存在,故密度最大。气态时水以单分子存在,使水汽化还要克服氢键力,因此水的沸点比分子量相近而分子间没有氢键的化合物的沸点高。同样原因,使水的温度升高也要消耗能量使缔合的分子破坏,因而水的比热大。温度较高的水洗物品易洗干净也是由于水中缔合的分子受到破坏,容易把脏物洗下来。
水只有微弱的导电性,水按下式发生自偶电离。
H2O+H2O ⇋H3O++OH-
可以简写成 H2O ⇋H++OH-
精确实验测得25℃纯水中的离子浓度是:
〔H+〕=1.0×10(-7次方)M
〔OH-〕=1.0×10(-7次方)M
水的电离度随温度升高而增大。
25℃时,纯水的理论电导率为5.5×10(-8次方)西/厘米(s/cm)换算成电阻率是18.2×10(6次方)欧姆·厘米(Ω·cm)(注:电导的单位西门子相当于米制的1/欧姆或姆欧)如果水中有了电解质,它的电导率将增加。测定水的电导率可以反映水中存在电解质的多少。但是要注意此法测不出非导电物质的污染。当纯水接触空气以后,空气中的二氧化碳溶于水,使其电导率增加,可达1×10(6次方)西/厘米,二氧化碳易用加热法除去,不影响使用。
水是很容易起化学反应的物质,它能和许多金属氧化物及非金属氧化物化合,和最活泼的金属(如钠等)反应放出氢,水也参与很多化学反应。