










硫的元素符号是S,原子量是32,硫的物理性质硫通常称做硫黄,是一种淡黄色的晶体,在实验室里,平常我们可以见到两种不同形状的硫:一种是黄色粉末状的,称做“硫华;另一种是淡黄色棒状的,称做“硫棒”,很脆,容易把它敲成碎块,或者研成粉末.硫具有八面体形的结晶,它的外形好象是由两个四面棱锥体的底面合在一起而形成的(图21)。
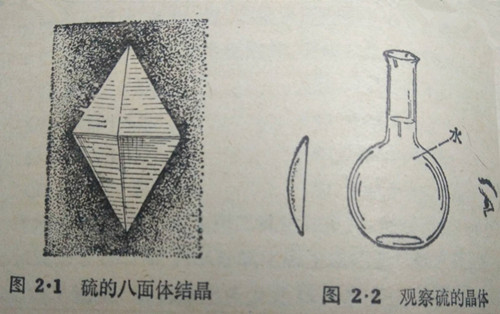
把硫粉溶解在二硫化碳(CS2)液体里,再把少许这种硫的二硫化碳溶液倒在玻璃上或蒸发皿里,让溶剂二硫化碳缓慢地蒸发干,就可看看到到有许多细小的硫的结品留存在玻璃上或蒸发皿里.用一个一般的放大就能很清楚地看到硫的八面体的晶形.如果没有放大镜,也可可以用一个盛水的圆底烧瓶来观察这些结晶(图2·2),它具有同放大镜相同的效能。
 硫在加热时会发生一系列有趣的变化:在试管里加进硫粉约半管,加热到113°C左右,硫就熔化成容易流动的深黄色的液体.继续加热,嫆化的硫就逐渐变得粘稠起来,颤色也开始变成暗棕色.当加热到200~250°C时,熔硫的粘性最大,即使把试管倒转竖直,也不会流出来,但当继续加热时,熔硫又开始从粘稠转成稀薄,到300C时,重又恢复成容易流动的液体.温度升高至444.6"C,熔硫开始沸腾而产生橙黄色的
硫在加热时会发生一系列有趣的变化:在试管里加进硫粉约半管,加热到113°C左右,硫就熔化成容易流动的深黄色的液体.继续加热,嫆化的硫就逐渐变得粘稠起来,颤色也开始变成暗棕色.当加热到200~250°C时,熔硫的粘性最大,即使把试管倒转竖直,也不会流出来,但当继续加热时,熔硫又开始从粘稠转成稀薄,到300C时,重又恢复成容易流动的液体.温度升高至444.6"C,熔硫开始沸腾而产生橙黄色的
蒸气,这种蒸气遇冷能不经液态而直接凝成硫的很小的晶形粉末,凝聚在试管上部的内壁上,就是硫华.
硫的比重是2.07克/厘米3,约是相同体积的水重量的两倍.它不溶于水,但容易溶解在二硫化碳里硫的化学性质硫的化学性质在许多方面和氧相似,只是不如氧活泼.硫也很容易跟氢气、几乎所有的金属(金和铂除外)以及某些非金属直接化合,但化合时反应常不如氧那样
剧烈.例如硫的蒸气在高温时能跟氢气直接化合生成硫化氢(H2S)气体:
S+h2=加热=H2S
(硫蒸气)
但这个反应不象氧气眼气化合时那样会产中,反出的热量也运比氢、氧化合时为少(生成1克分子硫化氢这个反及出4.8千卡的热量,但氧氢生成1克分子水菌气时,要数出57,8千卡的量)。
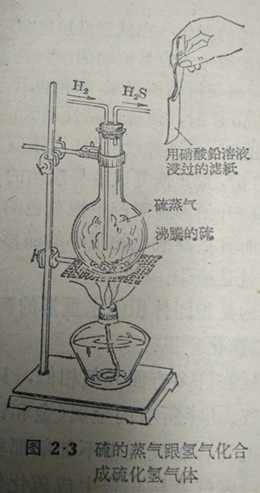
在烧瓶或试管加人硫粉,加热到硫沸腾,然后通人氢气(看图),在成试的导管口处能可P化氧所特有的味(和腐败鸡蛋发出的臭味相似,如果用一张蘸过铅盐(如硝酸铅)溶液的纸放在导管口,纸立刻变黑(因为生成了黑色的的硫化铅的缘故)。
硫跟金属直接化合后生成金属的硫化1物(相当于金属跟氧化合成后生成的金属氧化物)。分别生成硫化银和硫化汞反应的化学方程式:
2ag+S=Ag2S
硫化银
Hg+S=Hgs
硫化汞
用湿布蘸一些硫粉摩擦银器,不久,银器表面就的薄有黑色的硫化银层生成,把潮湿的硫粉和汞一同放在研缽里研磨,不久,就变成黑成硫化汞粉末。
铜、铁、铝、锌等金属,在加热条件下,也都能跟硫直接化合,生成相应的硫化物:
2Cu+S=加热=Cu2S
硫化亚铜
Fe +s=加热=Fes
硫化亚铁
2A1+3S=加热=Al2S3
硫化铝
Zn+S=加热=zNs
硫化锌
把硫粉和纯净铁粉混和后堆在石棉布上,另用玻棒一根,先把它的一端在酒精灯上烧至红热,然后迅速插入混和粉堆的中心,在和玻格接触处混和物首先发生反应,并迅速扩展到整个粉堆,发火燃烧.混和物在反应后变成块状的黑褐色的硫化亚铁。
硫也能跟某些非金属象碳、磷、氯等直接化合.例如,硫跟碳在高温时能够直接化合生成二硫化碳(这个反应相当于氧跟碳化合生成二氧化碳):
2S+c=高温=CS2
此外,硫还能跟氧相互化合.在讲氧气化学性质,已经讲过硫在空气或纯氧里都能燃烧,生成一种无色的、有刺激性的气体,叫做二氧化硫
硫在空气或纯氧里燃烧时,除生成二氧化硫气体外,同时还有极少量的三氧化硫生成.硫跟氧反应的化学方程式是:
S+02=SO2
二氧化硫
2S+302=2SO3
三氧化硫
从这两种硫的氧化物的分子式可以看出:在二氧化硫的分子里硫是4价;在三氧化硫的分子里硫是6价这是硫在一切化合物里的最高化合价。
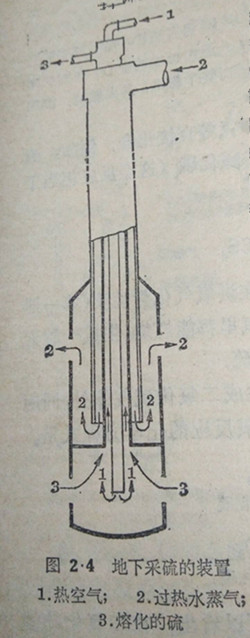 在自然界的存在硫和氧一样,在自然界里有以海离态存在(称做天然硫)的,也有以化合状态存在的天然硫存在于火山附近及地球上其他各处,我国也有不少地方有天然硫的矿天然大部認在岩石里,理在地下深处,开采硫矿,现在都用一种由三个组细不同的同心管组成的特种套管,从地面直通至硫的矿层.在外和1中管之间的网里通入过热达160C的3→水①,当它进到硫层时,就把硫熔化(硫的溶点约118C),熔的破集在外管的下.再由内管通入压缩的热空气,使熔题的硫成为泡状物质,经由内管和中言之间的道路出地面(图2-4),流至特设的容器内,逐渐凝固。
在自然界的存在硫和氧一样,在自然界里有以海离态存在(称做天然硫)的,也有以化合状态存在的天然硫存在于火山附近及地球上其他各处,我国也有不少地方有天然硫的矿天然大部認在岩石里,理在地下深处,开采硫矿,现在都用一种由三个组细不同的同心管组成的特种套管,从地面直通至硫的矿层.在外和1中管之间的网里通入过热达160C的3→水①,当它进到硫层时,就把硫熔化(硫的溶点约118C),熔的破集在外管的下.再由内管通入压缩的热空气,使熔题的硫成为泡状物质,经由内管和中言之间的道路出地面(图2-4),流至特设的容器内,逐渐凝固。
自然界里化合态的硫主要存在于各种含硫的矿物中,其中最重要的是金属的硫化物矿,例如:黄铁矿(FeS2)、黄铜矿(C2uS.Fe2S3)、方铅矿(PBS)、辰砂(HgS)等,此外,
还存在于各种硫酸盐的矿物中,例如:石膏(CaSO4:2H2O)、重晶石(Baso4)等。
我国硫化物矿的产地很广,产量也很丰富,一般生产的硫,主要是由黄铁矿制得的。
从黄铁矿制硫的方法是:先把矿石捣碎(黄铁矿很脆,容易捣碎),放进炉子里加热,并通入有有限量的空气,炉子里一部分矿石燃烧时放出的热,使其余的矿石分解,发生如下的反应:
Fes2=加热=FeS+S
这个反应里产生的硫蒸气,经冷却后,就可制得硫华或硫块。
硫的化合物还常存在于火山喷发出的气体中,也含于某些矿泉中,另外,硫是组成某些蛋白质分子的成分之一,因此,它是动植物生活的必需的元素.在土壤里,通常都含有硫的化合物供植物摄取硫的用途游离态的硫有着十分广泛的用途.硫华可以用来扑灭农业害虫,特别是用于葡萄园和棉田中.例如把硫粉撒在植物上来灭绝葡蚜(葡萄园的害虫)以及各种霉菌等.用硫华、生石灰和水熬煮而成的石灰硫黄合剂①,可以用来防止棉花的害虫红蜘蛛和棉花的叶斑病等.,在橡胶工业中,大量的硫用于橡胶的“硫化”②,天然的或人造的橡胶经硫化后,质量就大为提高.另外,硫还可以用来制造黑火药、火柴、二硫化碳以及其他许多重要产品.硫也可以用来制造硫酸.在医药上,硫主要用来做杀灭疥虫的软膏(称做“硫黄软膏”)。