











第三章 催化剂的研究和测试方法
工业催化剂研制的主要任务是寻找能化特定反应并能进行工业规模生产的催化剂。
在一般情况下,由实验室开始研催化剂到进行工业生产,通常要经过下列三1性能测定个阶段:
(1)实验室初步筛选;
(2)中间试验;
(3)工业装置试验。
催化剂在研制过程中的Ⅱ中间试验步骤如图3-1所示。
.jpg)
在第一个阶段,通常根据所研究的反应的性质,用第二章中叙述的适当方法制备催化剂。这时要对大量样品在各种条件下进行活性测动力学数据测定工业装置试验定,选择催化性能优良的催化剂配方。与此同时为了有指导的研制催化剂,常常用各种物理的或物理化学的方法进行测试,提供催化剂宏观和微观结构的数据。例如比表面、孔径分布、结晶构造等等。通过初步筛选,确定有可能工业化配方。
在第二个阶段,将实验室初步筛选的催化剂进行中间试验侧流试验。中间试验的目的,是在放大的条件下对催化剂进行考验,以求取基本的反应数据和决定使用期限。工厂侧流装置中的试验,可以提供催化剂在实际工业气体中所呈现的性能。因为实际气体可能含有痕量的有害杂质,所以,满意的通过这些试验的配方,就可以进一步在工业装置中试验。
由实验室对大量样品进行筛选和快速测定,再经过中间试验和工厂侧流装置,以获得基本的动力学数据。二次筛选出的催化剂,要进行更深入的动力学研究,以提供设计反应器的必要数据。
综上所述,为了适应催化剂的工业生产和研究,利用现代科学技术的成就,拟定了一系列新的研究和测试方法。如有各种结构的用于测定催化剂活性和研究动力学的微分反应器和积分反应器,以及各种测定扩散系数的方法用于测定催化剂强度的各种方法;用于测定比表面和多孔结构的各种气体吸附法和气相色谱法;用于催化剂体相结构研究的X一射线行射法和热谱法;用于研究表面结构和表面化合物的红外光谱法;“直接”观察的电子显微镜法,以及催化剂电学和磁学性质的各种测定方法。所用的定型仪器有比表面和孔径分布测定仪、色谱仪、X射线行射仪、差热分析仪、电子显微镜、电子探针、红外分光光度计、电子顺磁共振仪和核磁共振仪等。这些方法对缩短研制时间和节约人力物力具有重大意义。
本章将着重叙述在工业催化实验室里常用的研究和测试方法。
第一节 多相催化宏观动力学的研究和催化剂扩散系数的测定方法
多相催化过程由化学的和一系列物理的过程组成。在工业生产中,过程的总速度不仅与在催化剂表面上进行的化学反应速度有关,而且还受物质扩散和热传递的影响。宏观动力学就是研究物质扩散、反应时热的放出和分布、催化剂的结构以及催化剂表面变化对化学反应速度影响的规律的。因此,应用宏观动力学的知识,能正确的测定催化剂的活性、制备出具有指定宏观结构的催化剂和科学的设计工业反应器,在工业生产中也能提高催化剂的生产能力和催化剂的选择性。
本节简要叙述与催化剂宏观结构有密切联系的物质扩散现象和有效扩散系数的实验测定方法。
一、物质扩散对反应速度的影响
在多相催化反应中,反应物的分子由气流通过包围在催化剂颗粒外表面的气膜(外扩散),传递到催化剂颗粒的孔内深处(内扩散),并在孔的内壁上进行化学反应。反应产物分子则以相反的方向,由孔内经颗粒外表面的气膜传递到气流中去。过程在哪个区域里进行,决定于过程进行的条件。当条件变化时,可使过程由一个区域连续的过渡到另一个区域。
在生产条件下观察到的催化剂的表观活性,由于受到扩散的影响通常小于排除扩散影响后的催化活性。
在反应器中气体的流体动力学特性对外扩散有严重的影响。
1.外扩散对反应进行的影响
如果在过程进行时,物质由气流向催化剂颗粒外表面扩散困难,则在表面和气流之间能形成急剧的浓度差。此时,反应速度取决于外散速度,反应则由外扩散控制而处于外扩散区。
在外扩散区,反应物和反应产物在气流和催化剂外表面的浓度相差非常大,可用下列不等式表示:
Cs<<C0
CP′>>CP′′
式中
Cs和C分别表示反应物在颗粒外表面和气流的浓度;
Cp和C"分别表示反应产物在颗粒外表面和气流的浓度。
这时,Cs近于零。
根据费克第一定律,外扩散速度可用下式表示:
ω=KS(C0-Cs)
式中
ω一一外扩散速度;
K一一物质传递系数;
S一一颗粒的外表面。
因为反应在外扩散区进行,Cs≈0,则在外扩散区进行的过程的速度可用下式表示:
V≈KSC
为1级反应动力学方程式。
鲍列斯柯夫导出了在外扩散区进行的实际上不可逆反应的速度表示式为:
.png)
式中 P一一总压力;
pj一一给定组份的分压;
pi一一性气体的分压;
γ一一一包含换算系数的常数;
ν一一气体动力粘度,平方米/秒;
Φ一一催化剂的自由空间;
d0一一催化剂颗粒的换算尺寸,即与充填层密度无关的尺寸。
d0=4V0/S0
(V0和S0相应于催化剂颗粒的体积和表面积,即对于球形来说d=4/3R′,对于圆柱形来说d=2R′H/(R′+H),此处R一半径,H一粒子高度)。
当P,pi和pj以大气压表示,D(扩散系数)以平方米/时,UL(线速度)以平方米/秒,d0以米表示,反应速度以公斤-克分子/小时・立方米表示时,则γ=320。
由上式可见,扩散速度随扩散系数、线速度、给定组份分压的增加而增加,随惰性气体分压、催化剂颗粒的减小而增加。因而,采用小颗粒催化剂是有利的。
对于金属网催化剂,例如用于氨氧化的铂铑网催化剂,焦姆金导出了计算反应物浓度的公式如下:
㏒C0/Ci=0.591S′n/ULd[0,45+0.288(ULd)^0.56)
式中C和C1为反应物在金属网催化剂层前和层后的浓度,S′为1厘米^2金属网的几何表面,n为金属网数,UL为线速度,d为金属丝的直径(以厘米表示)。
外扩散与催化剂的性质、温度和压力存在下列关系。
(1)催化剂的活性越高,反度速度越快,因而更容易发生外扩散阻碍。当过程在外扩散进行时,催化剂的活性不能改变由外扩散阶段决定的过程的总速度(表观反应速度)。当催化剂的活性增加时,更加深了过程在外扩散进行。
(2)催化剂的多孔结构不再是重要的了。因为孔的大小和数量决定催化剂的内表面积,而内表面积这时已不起作用,反应仅在外表面进行。
(3)催化剂颗粒大小是一个重要因素。因为颗粒越小,反应物在气流和在表面的浓度越趋向一致。所以减小催化剂颗粒和降低活性,有利于过程由外扩散区向化学动力学区过渡。
(4)温度升高,所有的过程速度都加快。但是化学反应速度通常比扩散速度增长的快的多。因而升高温度有利于反应向外扩散区过渡,降低温度则有利于向动力学区过渡。
(5)降低压力,有利于扩散。
2.流体动力学特性对外扩散的影响
气流的流体动力学特性,对反应物的外扩散速度有很大的影响。气流在反应器中的流动,由于条件的不同可以是层流,也可以是湍流。在层流情况下,气流中的所有粒子(分子)以不变的线速度,作均匀而有序的运动。气体中任一点的粒子向其经过的催化剂颗粒外表面的传递,由扩散来实现。在湍流情况下,气流中的粒子以不稳定和无规则变化的速度,作无序的运动。这时气流不同部位粒子的线速度,各不相同,粒子的运动可能产生涡流,从而搅拌了整个气流。在这种情况下,粒子向其经过的颗粒外表面的运动,是靠穿过围绕颗粒表面气体薄层的扩散而实现的。薄层的有效厚度越小,向化剂外表面的散速度越快。当其他条件相同时,气流的流越强,层的有效厚度越小。
气体在反应管中流动的特性,决定于雷诺准数Re。
Re=Vd0/υ
式中 V一一气体的线速度,厘米/秒;
d0一一换算线度,厘米;
υ一一动力度,厘米秒。
而
d0=4v0/S
式中 v0一一颗化剂的体积;
S一一颗化剂的表面积。
在空管层流的情况下,Re值保持到2300。高于此值,则过渡到流。在填充工业催化剂颗粒的管中,当雷诺数为40~200时,层流即过渡到端流。
在大多数工业反应器中,通常雷诺数相应于气流处于流或过渡区内,所以由外扩散因素的阻得而导致过程的速度降低值,一般不大,只有百分之几。这时催化剂的过热,也不显著。
当外扩散速度大于在外表面上进行的化学反应速度,而化学反应速度又甚大于内扩散速度时,过程则由在表面上进行的化学反应速度控制。这样的条件称为外动力学区。
在外动力学区进行的反应速度相当快,以致反应物扩散到颗粒外表还没有进入颗粒深处,反应即已完成。但反应速度还不很快,否则过程就过渡到外扩散区。
外动力学条件只有在有效扩散系数小的细密的化剂颗粒上才可能出现。因为物质由气流向细颗粒表面传递,不会对反应产生阻抑作用。在此区内进行的过程的速度,与该反应在化学动力学区反应的规律一致。不过这时反应仅在颗粒外表面上进行。在生产中这种类型的过程很少见。
3.内扩散对反应速度的影响
气体分子从催化剂颗粒外表面沿孔系统向颗粒深处的扩散,与气相中的普通扩散不同。气体在孔中的扩散,除扩散分子之间的相互碰撞外,还与孔壁碰撞。这可能影响分子向颗粒深处的扩散速度。物质在孔中的扩散速度与扩散性质,显然与催化剂孔大小有关。
如果分子的平均自由距(λ)比孔的直径(2r)小,即2r/λ>1时,则分子之间将发生频繁的碰撞,而分子与孔壁的碰撞将急剧的减小。若2r/λ<1,则分子与孔壁碰撞的几率,大于分子间相互碰撞的几率,由于分子与孔壁的频繁碰撞,而使扩散速度减小。
已知λ在大气压下=10^5厘米。根据不等式2r>λ,只有当催化剂的平均孔径r≥10000Å时,才满足一般扩散的条件。这时扩散系数D与孔径大小无关。由于与λ压力P成反比,所以扩散系数D也与压力P成反比。这就是说,压力越大,扩散系数越小,亦即分子达到催化剂的内表面越困难。
当催化剂的平均孔径r≤1000Å时,则出现内扩散现象。升高压力,促使扩散向较小孔径方向转移。例如,在P=300大气压时,λ=10^-7厘米,则只有在最细的孔中(数量级10Å)内扩散才是明显的。相反的,在低压下,例如P=0.01大气压,因为λ=10^-3厘米,所以在所有的孔中都是内扩散的。
与一般的分子扩散不同,内扩散系数D,亦称有效扩散系数,与孔的大小有关:
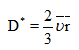
式中 v为分子运动的平均速度,在一般条件下约为10^5厘米/秒,当r由10Å改变到10000Å时,有效扩散系数由0,01变到10厘米^2秒。
根据气体运动论
v^2=3RT/M
式中M为分子量。由此得:

此式表示,有效扩散系数与温度的平方根和平均孔径成正比,与分子量的平方根成反比。
分子在化剂孔中扩散的形式与压力和温度的关系列于表3-1。
.jpg)
现在我们来分析不同条件下在催化剂孔中进行的过程。当化学反应速度甚小于内扩散和外扩散速度时,催化剂颗粒深处(中心)反应物的浓度接近颗粒表面、气流中的浓度。这时称反应在化学动力学区或内动力学区进行。
当反应在动力学区进行时,反应物在颗粒深处由于反应进行而引起的浓度降低,来及补充。所以在催化剂的全部孔中,反应物的浓度相同,因而化剂全部内表面被均匀的利用。
当化学反应速度甚大于内散速度,而内扩散速度又甚小外扩散速度时,反应物在颗粒外表面的浓度与气流中的浓度近。但在颗粒深处的浓度由于反应进行来不及补充,可能甚小表面的浓度而近于零。这时整个过程由内扩散控制。而称反应于内扩散区。显然,这时催化剂内表面未充分利用。
.jpg)
反应物在多孔催化剂颗粒中沿深度的浓度分布示于图3-2中曲线1和曲线2为反应在动力学区和内扩散区进行时反应物浓度分布。可见在动力学区颗粒中心的浓度与颗粒外表面的浓度接近。但在内扩散区,越向颗粒中心浓度越低。反应物在颗粒中心的浓度近似于零。这时得下列不等式:
Co≈Cs>> CB
CΦ≈0
反应产物则以相反的方向由颗粒深处向外表面扩散,故
Cp′<<Cm^p
Cp′和Cm^p分别表示反应产物在外表面和颗粒深处的浓度。
在内护散区,有关多孔催化剂宏观结构对反应速度影响的严格定量计算,是个复杂的数学问题。惠勒用近似处理方法,得到一级反应速度与催化剂宏观结构的关系式如下。

式中 K一一级反应的比速度常数,以催化剂单位表面积为基准;
D*一一有效扩散系数,厘米/秒;
vg一一每克催化剂的气孔体积,立方厘米/克;
Sg一一催化剂的比表面,厘米^2/克;
d一一催化剂的颗粒直径,厘米;
C0一一反应物在化剂颗粒孔口的浓度,克分子/立方厘米;
pB一催化剂的堆积密度,克/立方厘米。
由上式可以得出一个重要结论,即对于在内扩散区进行的多级反应,反应速度与有扩散系数、气孔体积和比表面的平方想成正比,而与颗粒直径成反比。这在实用上是有意义的,为了增加化剂的生产能力,应当减小粒径,或改变化剂的多孔结构,以便最大限度的增加有效扩散系数,同时又不降低催化剂的气孔体积和比表面。
4.扩散的过渡区
在多孔催化剂上,过程除在外扩散区、内扩散区、外动力学区和内动力学区进行外,还有可能在两个过渡区域之一内进行,即在内动力学与内扩散之间的内过渡区域和在内扩散与外扩散之间的外过渡区域。反应究竟在哪个区域里进行,决定于催化剂的活性和宏观性质,以及温度、压力和气流速度等条件。当其他条件不变时,变更温度可以察到反应连续的由一个区域向另一个区域的过渡。
.jpg)
在多孔催化剂上反应速度与温度的关系示于图3-3。图中曲线1为典型的S型,表示反应受扩散阻碍。当没有扩散影响时,反应速度与温度的关系应以曲线2(虚线)描述。
与图3-3相应的反应速度常数的对数与绝对温度倒数的关系绘于图3-4。直线(虚线)对应于反应在动力学区进行。曲线1的Ⅰ段对应着在较低温度下进行反应的动力学区,这时反应的活化能和反应级数都是真实的。曲线1的Ⅱ段,对应于中温的内扩散区,这时表观的活化能和反应级数分别为E/2和(n+1)/2。曲线1的Ⅲ段,对应着高温的外扩散区,这时活化能近于零E→0,反应级数n=1。
由上述可知,在多孔催化剂上用普通方法得到的动力学常数(K、E和m)常被歪曲。所以,不能仅依据这些数据来作结论。
由于条件不同,过程可能在不同的区域里进行。反应在各区进行的特点列于表3-2。催化剂内表面利用率决定于过程进行的区域,因而与其宏观结构有关。
.jpg)
在动力学区,由于不存在内扩散的影响,全部内表面均匀的起催化作用,所以催化剂内表面利用率最高。这时化剂单位体积或单位重量的生产能力也最高。
在工业上为了提高催化剂的生产能力,应当使反应在动力学区或接近动力学区进行。为此,通常采取两种方法。一个是变更催化剂的制备方法,以求制得具有足够的比表面和适孔径分布的催化剂,另一个是在工程上采用可充填小颗粒側化剂的流化和径向反应器。关于流化床和径向反应器,将在第四章中叙述。
二、隔膜法研究宏观动力学和测定有效扩散系数
隔膜法是研究宏观动力学和测定有效扩散系数的方法之这两种实验可用同一种装置。
1.宏观动力学的研究
实验时将催化剂压成一定尺寸和厚度均匀的圆柱形片状隔膜。将隔膜放在反应管中,使隔膜与管壁紧密接触,反应管被分成两个小室,气体在两个小室中的交换仅由通过隔膜细孔的扩散来完成。为了壁免隔膜两侧因压力不等而产生的交换,在两个小室中应保持相同的压力。
用隔膜法研究宏观动力学的实验装置可采用下列两种类型:
.jpg)
(1)双流通室反应器反应器的两个小室都是流通的(图3-5)。反应混合气体通过反应管的两管夹层空间,流经化剂隔膜一侧的表面,然后从内管中流出。性气体(或反应组份之的气体)以同样方式流经反应器的另一小室。可用差示压力计调节两个小室处于等压状态。这时反应混合气体从隔膜的一侧经过隔膜的微孔系统向另一侧扩散,同时在孔中进行化反应。扩散到隔膜另一侧的反应混合气体,被以恒定流速通过的性气体(或反应组份之一的气体)“洗去”。然后进行分析。根据反应物在隔膜两侧的浓度变化,就能确定反应物通过催化剂的反应速度和扩散速度。
研究乙炔氧化宏观动力学的双流通室反应器的结构绘于图6。反应管中的催化剂隔膜是用二氧化锰粉末压成。经过预热的乙和空气的混合物流经隔膜的一面,这一面模拟催化剂颗粒的外表面。空气经过预热后以一定速度通过隔膜的另一面,这一面模拟催化剂的颗粒中心。乙炔和空气的混合物由隔膜的一面沿隔膜中的孔道向另一面扩散,并进行氧化反应。因而,扩散到另一面的反应物和反应产物的混合气体被流过的空气“洗去”。然后进行分析。当没有催化反应时,乙炔在隔膜中的浓度梯度应当保持线性关系。根据在两种情况下乙炔浓度的变化,即可算出在二氧化锰上乙炔的扩散速度和反应速度,以及物质扩散过程对乙炔氧化反应速度的影响。
.jpg)
(2)单流通室反应器单流通室反应器与双流通室反应器的基本区别在于它只有一个小室是流通的,另个小室则是封闭的。用面向封闭区的隔膜表面模拟催化剂的颗粒中心。单流通室反应器原理示于图3-7。
为了测定反物和产物在空向的度,将此时与环和特别结构的取样瓶连接。反应装置给于图3-8。
.jpg)
2.有效扩散系数的测定
隔膜法测定有效扩散系数的仪器装置,可用研究宏观动力学的装置来测定。测定时将含有一定浓度欲测物质的稀释剂通过隔膜的一面,另一面通过稀释剂或其他气体。当过程达到动态平衡时,分析纯稀释剂中欲测物质的浓度,算出欲测物质的扩散速度,从而算出有效扩散系数。
若被测物质在反应管第一个小室的浓度为C0,克分子/立方厘米,护散速度为ω,克分子/秒,在第二个小室中的浓度为C,克分子/立方厘米,隔膜的横截面为S厘米^2,厚度为ρ厘米。则有效扩散系数可按费克方程式算出:
ω=D*(CO-C)S/ρ
由此得
D*=ωρ/(C0-C)S
比较C0与C之值,可定性的判断过程进行的区域。当C0与C相差很小,则过程基本上在动力学区进行。当C0甚大于C,C近于零,则过程在内扩散区进行。
此外由隔膜求得的C0、C、ω和D*的测定值,利用下式可以算出过程的特征值,K,E、n:
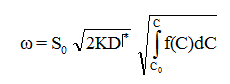
这样求得的速度常数活化能和反应级数是动力学区的特性常数,不受宏因素的影响。上式中K为动力学区的速度常数(对应于1厘米^3催化剂);S0为膜的横截面积。
由颗粒半径为r组成的1厘米催化剂的生产能力,可用下式表示:
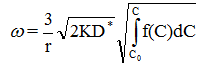
由上式可知,多孔催化剂的生产能力,与催化剂的颗粒半径成反比,与有数扩散系数的平方根成正比。这对实际工作有重要的意义。因为如果希望提高催化剂的生产能力,必须减小催化剂的粒径,或者改变催化剂的孔结构以便最大限度的增大D*,又不降低比表面。
因此,具有最适结构的催化剂,应当在有粗孔的壁上有细孔。粗孔作为分子的运输孔道。细孔提供大的表面积,以进行催化反应。
当反应在内扩散区进行时,在多孔催化剂颗粒内部,反应物受到扩散阻。这时能观察到催化剂的生产能力与其颗粒大小有关,粒径减小,生产能力增大。当粒径减小到一定程度时,生产能力不再随之增加这时过程就在动力学区进行了。这是实验室里检验反应是否受扩散影响的最常用和最简便的方法。
